Bilde 1 . Eks. på molekylær maskin
ATP syntase er i nyhetene igjen, og den er enda bedre enn før. Før du hører nyhetene, kan det være verdt å se gjennom animasjonen av denne lille rotasjonsmotoren som driver livet, fra bakterier til mennesker -her. Du drives av billioner av disse små motorene akkurat nå. Nyheten er at de er perfekte.
Man ser ikke ofte ordet "perfekt" i et vitenskapelig papir, men fire japanske forskere bruker ordet ufortrødent, ufattelige 13 ganger i deres artikkel i 'Proceedings of the National Academy of Sciences' -her , inkludert tittelen: "Perfekt kjemomekanisk kopling av F0F1-ATP syntase."
"Peter D. Mitchell, en nobelproducent i 1978, foreslo at F0F1-ATP-syntase omdanner energi mellom elektrokemisk potensial for H+ over en biologisk membran... som er etablert av respiratoriske kjedekomplekser og kjemisk potensial for adeninukleotid [ΔG (ATP)]. Effektiviteten til energikonverteringen har imidlertid vært emne for debatt i over 50 år. I denne studien med et svært reproduserbart analytisk system ved bruk av F0F1-ATP-syntase fra termofil Bacillus, ble tilsynelatende perfekt energikonvertering observert. Mitchells prediksjon har således kvantitative bevis."
Du kan ikke bli bedre enn perfekt. Dette betyr at hvert proton (H+) som kommer inn i maskinen, kjører sin rotasjon, gir 100 prosent omdanning av sin energi til produksjon av ATP. Kan du tenke på en hvilken som helst menneskeskapt motor som er i nærheten av denne typen effektivitet? Neppe. På vårt makronivå av ingeniørfag, sløser kunstige motorer energi gjennom varme, friksjon og utslipp av drivstoff til miljøet. Den andre loven om termodynamikk forbyr fullkommenhet. På en eller annen måte, på skalaen av nanometer (milliardte-dels meter), får ATP-syntasemotorer et maksimalt 'bang' for proton-partikkelen sin- uten tap i det hele tatt.
Debatten om ATP-syntase-energieffektivitet er sentrert om den numeriske mismatchen mellom maskinens to halvdeler. F0- delen, hvor protoner går inn, har 10 enheter kalt c -underenheter som er arrangert som appelsinskall som roterer rundt en sentral akse. F1-delen har derimot 3 enheter i par, kalt β-underenheter, hvor ATP-syntese finner sted (de to halvdelene er forbundet med en sentralstengel kalt y-underenheten som fungerer som en kamaksel). Denne 10/3 ikke-heltallsparingen mellom F0 og F1 var uventet, og førte ledende biofysikere til å anta at det må være noe sluring i kamakselet under hver rotasjon. Sluring vil sløse vekk noen av proton-bevegelseskraften (pbk), noe som reduserer effektiviteten.
En måte å finne svaret på er å sammenligne inngangen med utgangen så nøyaktig som mulig. Disse forskerne rigget et proteoliposom fra en termofil (varme-elskende) bakterie på en ny måte som tillot dem å pålidelig måle innkommende pbk så vel som den utgående produksjonen av ATP.
Bilde 2. ATP-motoren
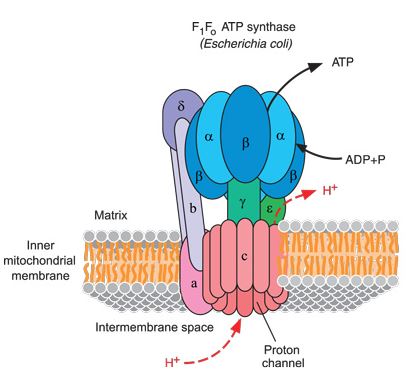 "I denne rapporten brukte vi dette systemet til å bestemme den faktiske H+/ ATP-forholdet. Resultatene viser den perfekte overenskomsten av H+/ATP-forhold til c/beta, hvilket indikerer tett koblingseffektivitet for proton-omflytting i F0- og ATP-syntese/hydrolyse i F1 . I tillegg ble kinetisk og energisk ekvivalens av transmembran-forskjellen mellom pH (ΔpH) og elektrisk potensial (delta ψ) støttet med uovertruffen sikkerhet over et bredt spekter av pbk -verdier."
"I denne rapporten brukte vi dette systemet til å bestemme den faktiske H+/ ATP-forholdet. Resultatene viser den perfekte overenskomsten av H+/ATP-forhold til c/beta, hvilket indikerer tett koblingseffektivitet for proton-omflytting i F0- og ATP-syntese/hydrolyse i F1 . I tillegg ble kinetisk og energisk ekvivalens av transmembran-forskjellen mellom pH (ΔpH) og elektrisk potensial (delta ψ) støttet med uovertruffen sikkerhet over et bredt spekter av pbk -verdier."
Teamet eliminerte nøye all forurensning, kjørte testene i mange timer, og redusert feil for å oppnå enestående nivåer av nøyaktighet. "En lang ventet, men ubevist, oppfatning at F0F1 oppnår en perfekt kopling mellom transmembran H+ translokasjon og ATP syntese/hydrolyse har direkte eksperimentelle bevis nå," konkluderer de.
Hvordan er dette mulig? Er det ikke noen 'sluring'? Er det ikke vridningskraft av dreiemoment når kamakslen presser mot beta-underenhetene i F1? Og hva med andre versjoner av ATP syntase i andre organismer som har 8, 12 eller 14 c underenheter i F0? De tar opp disse spørsmålene i siste avsnitt i diskusjonen:
"I en termodynamisk visning betyr den perfekte kobling, perfekt energi-omgjøring mellom kjemi-osmotisk (H+ translokasjon), mekanisk ( rotasjonsbevegelse ) og kjemisk energi (ATP-syntese/hydrolyse). En nær perfekt energi-konvertering fra ATP hydrolyse til rotasjonsbevegelse av gamma-underenhet i F1 ble nylig demonstrert på en termodynamisk definert måte, og denne studien forutser at andre omdannelser også bør være svært effektive. I en mekanistisk visning betyr den perfekte koplingen at det ikke er 'sluring' i og mellom motor F0 og F1. Atomstrukturer av F1 bekrefter at rotasjonsbevegelsen av gamma-underenheten ikke kunne oppstå uten konformasjons-endring av de katalytiske underenheter. Strukturelt grunnlag for rotasjon av motor F0 uten sluring, har blitt foreslått nylig av atomstrukturer av hele F0-F1, avdekket ved kryo-elektron mikroskopi. Tilkoblingen mellom de to motorene skal også være sterk nok til å utholde dreiemomentets vridningskraft . Krystallstrukturer av F1·c- ringkomplekser indikerer at forbindelsen ser ut til å være holdt av et lite antall interaksjoner mellom bunnpartiet av F1's rotor og polarløkker i c-ringen. Interessant nok, må denne forbindelsen må være allsidig , fordi fusjonen TF0F1 med erstattet F0 fra Propionegenium-modestum, som har 11 c underenheter, viser god koblings- aktivitet."
Dette er en bemerkelsesverdig ting. Perfekt-men allsidig! Du kan erstatte en annen c-ring til F0 og fortsatt få "god kombinert aktivitet." Prøv det med menneskeskapte motorer!
Andre 'perfekte poeng'
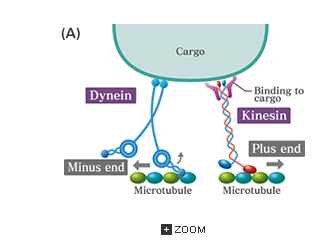 Kinesin, 'gåmaskinen' (se animasjonen -her ), er en annen "perfekt 10" utøver. Som ATP-syntasen konverterer den kjemisk energi til mekanisk energi. Det har endog hva forskere kaller et "kraft-slag" når den går. Tomonami Sumi fra Okayama University i Japan sammenlignet maskinens gangevirkning med dens ATP-forbruk. Publisering i Nature Scientific Reports -her, fant han at " forholdet mellom antall ATP-hydrolyser til antall trinns fremrykning, antyder en tett kopling mellom de to." Tett kobling ; Vi hørte det i den forrige historien. Selv om han ikke bruker ordet perfekt , snakker han beundringsverdig om kinesinens "ekstraordinære motoregenskaper". Det ser ut til at japanerne er mindre forhindret i å bruke d- ordet (design). Sumi's tittel er: "Design-prinsipper for kjemomekanisk kobling av kinesin."
Kinesin, 'gåmaskinen' (se animasjonen -her ), er en annen "perfekt 10" utøver. Som ATP-syntasen konverterer den kjemisk energi til mekanisk energi. Det har endog hva forskere kaller et "kraft-slag" når den går. Tomonami Sumi fra Okayama University i Japan sammenlignet maskinens gangevirkning med dens ATP-forbruk. Publisering i Nature Scientific Reports -her, fant han at " forholdet mellom antall ATP-hydrolyser til antall trinns fremrykning, antyder en tett kopling mellom de to." Tett kobling ; Vi hørte det i den forrige historien. Selv om han ikke bruker ordet perfekt , snakker han beundringsverdig om kinesinens "ekstraordinære motoregenskaper". Det ser ut til at japanerne er mindre forhindret i å bruke d- ordet (design). Sumi's tittel er: "Design-prinsipper for kjemomekanisk kobling av kinesin."
Bilde 3. Dynein og Kinesin-cellearbeidrne
Cohesin og condensing er proteiner som bidrar til å holde DNA organisert. En interessant artikkel skrevet som en mysteriehistorie i Nature News -her, viser hvordan forskere prøver å finne ut om de jobber som motorer. Forfatter Elie Dolgin kaller det "DNAs hemmelige våpen mot knuter og forvikinger". Det er noe som retter ut sløyfer i DNA, og arbeider for å "holde lokale DNA-regioner samlet, og løsgjøre dem fra andre deler av genomet og til og med gir form og struktur til kromosomene. "Men uansett, det må være 'over fatteevne' om MIT biofysiker Leonid Mirny modell er riktig:
"For det første forblir identiteten til den molekylære maskinen som danner løkkene et mysterium. Hvis den ledende proteinkandidaten opptrådte som en motor, slik Mirny foreslår, vil det forbruke energi raskere enn det noen gang har vært sett å gjøre." Som en fysiker-venn av meg forteller meg,"Dette er et slags Higgs-boson for ditt felt ", sier Mirny; Det forklarer en av de dypeste mysterier i genom-biologi, men som det kan ta år å bevise."
 Løpet er i gang for å finne ut hvilken type motor som forbruker ATP til å dra og trekke DNA. Løkke-utstrekning forhindrer ikke bare knuter og forviklinger, det regulerer genuttrykk ved å holde deler av gener i nærheten. Vi forventer at dette mysteriet vil ha en "perfekt" slutt.
Løpet er i gang for å finne ut hvilken type motor som forbruker ATP til å dra og trekke DNA. Løkke-utstrekning forhindrer ikke bare knuter og forviklinger, det regulerer genuttrykk ved å holde deler av gener i nærheten. Vi forventer at dette mysteriet vil ha en "perfekt" slutt.
Til slutt, det kjente ikonet bakterie-flagellen trekker et nytt trikk opp fra ermet. Hvordan vet drivakslen når den skal slutte å vokse? Et artikkel i Science -her viser at den "mest effektive maskinen i universet", som Howard Berg kaller den, har en perfekt løsning: den vokser til den berører periplasma (ytre membranlag). Mens vi forundres over ingeniør-kunsten, skal vi gi evolusjonen kreditt?
"Bakterie-flagellen eksemplifiserer et system hvor selv små avvik fra den høyt regulerte flagellar monterings-prosessen kan avskaffe bevegelighet og forårsake negative fysiologiske utfall. Følgelig har bakterier utviklet elegante og robuste regulatoriske mekanismer for å sikre at flagellær morfogenese følger en definert vei, med hver komponents selvmontering til forutbestemte dimensjoner. Flagellarstaven virker som en drivaksel for å overføre dreiemoment fra den cytoplasmatiske rotoren til det eksterne filament. Stangen selvmonterer til en definert lengde på ~ 25 nanometer. Her gir vi bevis på at stanglengden er begrenset av bredden av det periplasmatiske mellomrom mellom indre og ytre membran. Lengden på Brauns lipoprotein bestemmer periplasmatisk bredde ved å tette den ytre membranen til peptidoglykan-laget."
Bilde 4. Bakterie-flagellen
Science Daily tilføyer -her , "For å fungere riktig og drive bakterien, krever flagellen at alle komponentene passer sammen til nøyaktige mål." Den voksende "drivaksel" føler på en måte det ytre laget og vet å slutte å vokse. "Stangen må røre innsiden av ytre membranen," sier en av forfatterne. "Så, hvis den ytre membranen er lenger unna, må stangen vokse for å møte den." Den allsidige vekstprosessen gir en perfekt passform.
Hvis du kan tenke på en eneste maskin i din erfaring som er perfekt, men likevel fleksibel, ble den nok ikke til gjennom blinde, målløse naturlige prosesser. La oss slutte å la darwinister komme unna, u-utfordret, ved å si at de "har utviklet seg" til perfeksjon.
Stoffutvalg og bilder ved Asbjørn E. Lund
 Oversatt fra: https://www.evolutionnews.org/2017/05/molecular-machines-reach-perfection/
Oversatt fra: https://www.evolutionnews.org/2017/05/molecular-machines-reach-perfection/ Oversatt fra: https://www.evolutionnews.org/2017/05/molecular-machines-reach-perfection/
Oversatt fra: https://www.evolutionnews.org/2017/05/molecular-machines-reach-perfection/ "I denne rapporten brukte vi dette systemet til å bestemme den faktiske H+/ ATP-forholdet. Resultatene viser den perfekte overenskomsten av H+/ATP-forhold til c/beta, hvilket indikerer tett koblingseffektivitet for proton-omflytting i F0- og ATP-syntese/hydrolyse i F1 . I tillegg ble kinetisk og energisk ekvivalens av transmembran-forskjellen mellom pH (ΔpH) og elektrisk potensial (delta ψ) støttet med uovertruffen sikkerhet over et bredt spekter av pbk -verdier."
"I denne rapporten brukte vi dette systemet til å bestemme den faktiske H+/ ATP-forholdet. Resultatene viser den perfekte overenskomsten av H+/ATP-forhold til c/beta, hvilket indikerer tett koblingseffektivitet for proton-omflytting i F0- og ATP-syntese/hydrolyse i F1 . I tillegg ble kinetisk og energisk ekvivalens av transmembran-forskjellen mellom pH (ΔpH) og elektrisk potensial (delta ψ) støttet med uovertruffen sikkerhet over et bredt spekter av pbk -verdier." Kinesin, 'gåmaskinen' (se animasjonen -her ), er en annen "perfekt 10" utøver. Som ATP-syntasen konverterer den kjemisk energi til mekanisk energi. Det har endog hva forskere kaller et "kraft-slag" når den går. Tomonami Sumi fra Okayama University i Japan sammenlignet maskinens gangevirkning med dens ATP-forbruk. Publisering i Nature Scientific Reports -her, fant han at " forholdet mellom antall ATP-hydrolyser til antall trinns fremrykning, antyder en tett kopling mellom de to." Tett kobling ; Vi hørte det i den forrige historien. Selv om han ikke bruker ordet perfekt , snakker han beundringsverdig om kinesinens "ekstraordinære motoregenskaper". Det ser ut til at japanerne er mindre forhindret i å bruke d- ordet (design). Sumi's tittel er: "Design-prinsipper for kjemomekanisk kobling av kinesin."
Kinesin, 'gåmaskinen' (se animasjonen -her ), er en annen "perfekt 10" utøver. Som ATP-syntasen konverterer den kjemisk energi til mekanisk energi. Det har endog hva forskere kaller et "kraft-slag" når den går. Tomonami Sumi fra Okayama University i Japan sammenlignet maskinens gangevirkning med dens ATP-forbruk. Publisering i Nature Scientific Reports -her, fant han at " forholdet mellom antall ATP-hydrolyser til antall trinns fremrykning, antyder en tett kopling mellom de to." Tett kobling ; Vi hørte det i den forrige historien. Selv om han ikke bruker ordet perfekt , snakker han beundringsverdig om kinesinens "ekstraordinære motoregenskaper". Det ser ut til at japanerne er mindre forhindret i å bruke d- ordet (design). Sumi's tittel er: "Design-prinsipper for kjemomekanisk kobling av kinesin." Løpet er i gang for å finne ut hvilken type motor som forbruker ATP til å dra og trekke DNA. Løkke-utstrekning forhindrer ikke bare knuter og forviklinger, det regulerer genuttrykk ved å holde deler av gener i nærheten. Vi forventer at dette mysteriet vil ha en "perfekt" slutt.
Løpet er i gang for å finne ut hvilken type motor som forbruker ATP til å dra og trekke DNA. Løkke-utstrekning forhindrer ikke bare knuter og forviklinger, det regulerer genuttrykk ved å holde deler av gener i nærheten. Vi forventer at dette mysteriet vil ha en "perfekt" slutt.